ADAPTACIÓN DE CULTIVOS CELULARES SIN AMBIENTE DE CO2, DESCONGELACIÓN, MANTENIMIENTO Y ENSAYOS DE PLAQUEO VIRAL.
Delia Piedad Recalde-Reyes, Carlos Andrés Rodríguez Salazar, Jhon Carlos Castaño Osorio
Abstract
Este método de cultivo celular es una adaptación para cultivo de líneas celulares eucariotas que tradicionalmente necesitan de una atmósfera de CO2 al 5% para su crecimiento ; la presente adaptación se realiza con el fin de facilitar el crecimiento de líneas celulares eucariotas en laboratorios que presenten dificultad de acceso a CO2.
Este método se basa en el protocolo descrito en 2005 por el Departamento de Virología, Centro Colaborador de la OPS / OMS para Enfermedades Virales, Instituto de Medicina Tropical "Pedro Kourí", La Habana, Cuba: "Improved Dengue Virus Plaque Formation on BHK21 and LLCMK2 Cells: Evaluation of Some Factors" Mayling Alvarez, Rosmari Rodriguez-Roche, Lídice Bernardo, Luis Morier and Maria G. Guzman! Department of Virology, PAHO/WHO Collaborating Center for Viral Diseases, "Pedro Kourí" Tropical Medicine Institute, Havana, Cuba.
Este protocolo ha sido probado con éxito en las líneas celulares: HepG2, Huh-7, BHK, VERO, para ensayos de crecimiento/mantenimiento, congelación y ensayos de plaqueo viral.
Este protocolo fue desarrollado gracias al apoyo administrativo de la CUE Alexander von Humboldt de Armenia en convenio con la Universidad del Quindío y desarrollado dentro de la ejecución de los proyectos: Desarrollo de una prueba de western blot para detección de antígenos virales de dengue serotipos 1–4 y Evaluación de la citotoxicidad y producción de citoquinas pro-inflamatorias (IL-1b, INF-y, IL-6, IL-10, TNF α) de leucocitos humanos que interactúan con liposomas cargados con siRNA contra el virus del dengue.
Before start
Preparar los siguientes medios y reactivos para uso en cultivo celular:
Medio RPMI 1640 powder con L-glutamina sin bicarbonato Gibco.
Medio DMEM powder con L-glutamina sin bicarbonato Gibco.
Medio MEM powder con L-glutamina sin bicarbonato Gibco.
Suero fetal bovino bajo en endotoxinas Gibco o Sigma.
Antibiótico antimicótico para cultivo celular 100X= Penicilina 10000 unidades/ml streptomicina 10000unidades/mL.
Caldo Triptosa fosfato Sigma.
Bolsas plásticas de cierre hermético.
Buffer fosfato salino “PBS” 1X.
Carboximetil celulosa baja densidad al 3% (3 gramos para 100mL y autoclavar), para emplear en concentración final de 1,2% en medio overlay.
Medio de fijación: Formol al 4% disuelto en PBS 1X
Cristal violeta
Etanol absoluto grado biología molecular.
Steps
Preparación de medios de cultivo. El medio de cultivo a utilizar dependerá de cada una de las líneas celulares como se observa en la tabla 1 y se debe suplementar empleando: Antibiótico antimicótico 1X, Suero fetal bovino 10%, Caldo Triptosa fosfato 10%, cabe destacar que el medio MEM para las células HepG2 puede prepararse con bicarbonato al 0,5% y no utilizar Triptosa fosfato.Disolver cada sobre de medio de cultivo en 250ml de agua estéril desionizada; aforar a 500ml en un frasco estéril. Después de diluir el medio de cultivo se le añade 10 ml de bicarbonato de sodio, con el fin de ajustar el pH, para ajustar el protocolo para crecer las células sin CO2 algunos de los medios no se adiciona bicarbonato. Filtrar los medios de cultivo en otro frasco estéril con un filtro de 0.2μm y con la ayuda de una jeringa o mediante equipo de filtración al vacío. Se marca como medio 2x, y se guarda en nevera de 2-8ºC.Como el medio se encuentra a 2X se diluye con 500 mL de agua estéril para preparar una solución a 1X, si el medio de cultivo es para realizar la técnica de plaqueo de virus Dengue este se debe trabajar a 2X.NOTA: la preparación de estos medios se lleva a cabo según recomendación de los fabricantes, por ello es de gran importancia antes de la reconstitución de estos ver el inserto del producto, si los medios ya cuentan con bicarbonato no se deben adicionar los 10 mL adicionales, tampoco si el medio con el que cuentan en el laboratorio es líquido y ya tiene bicarbonato. Si el medio no cuenta con L-glutamina se debe adicionar al 1%. Tabla 1. Medios de cultivo utilizados cada línea celular.
| A | B | C | D |
|---|---|---|---|
| Medio en polvo | Agua destilada | Bicarbonato de sodio al 7,5% | Línea celular |
| RPMI 1640 1X | 1000mL | - | BHK |
| RPMI 1640 2X (plaqueo) | 500mL | - | BHK |
| DMEM 1X | 990mL | 10mL | Huh-7, VERO |
| MEM 1X | 990mL | 10mL | HepG2 |
Preparación Triptosa fosfato: Con el fin de evitar dilución del medio de cultivo la preparación del caldo triptosa fosfato debe realizarse 4X (4 veces concentrada); de manera que deberá pesarse 118g de caldo triptosa fosfato en 1000 mL de agua destilada o 11,8g en 100 mL de agua y autoclavar. Se emplea como una solución al 400% Preparación de Carboximetilcelulosa de viscosidad media Para preparar 1L de Carboximetilcelulosa al 3% se pesan 30g y se diluyen en agua estéril, se deja reposando a 4ºC overnight, posteriormente se mezcla mediante agitación y se autoclava 15 minutos a 121ºC y 15 libras de presión. Medio OVERLAY para la técnica de titulación mediante plaqueo. Emplear medio RPMI 2X, Carboximetilcelulosa de viscosidad media al 1,2% (concentración final), suero fetal bovino bajo en endotoxinas 2%, antibiótico antimicótico 1X, caldo triptosa fosfato 10%, bicarbonato de sodio 500uL.
Descongelación e incubación a 37ºC para el crecimiento de células sin atmósfera de CO2. 2.
-
Del tanque de nitrógeno líquido se retiran las células, se descongelan en baño maría o baño seco a 37 ºC, con el fin de descongelar en el menor tiempo posible y evitar daño o alteraciones.
-
Se centrifugan a 150 x g por 5 min. (En algunas ocasiones es preferible sembrar las células sin centrifugar y a las 4 horas realizar cambio de medio)
-
Después de centrifugar se llevan a la cámara de flujo laminar donde se elimina la solución en la cual están criopreservadas y el precipitado se resuspende con 1ml de medio de cultivo (tener en cuenta en el medio de cultivo en el que fueron congeladas las células para resuspenderlas en el mismo medio).
-
Después de resuspender las células en medio de cultivo se agregan en una caja de cultivo de 25ml más 4ml de medio y se suplementan con SFB 10%, Antibiótico 1X y Triptosa fosfato al 10%, las cajas de cultivo deben taparse totalmente por lo que se recomienda no utilizar cajas con filtro, (si solo se cuenta con cajas con filtro, éste puede taparse totalmente con parafilm), estos cultivos se guardan a 37ºC. Las células HepG2 tambien pueden mantenerse sin CO2 utilizando MEM 1X con bicarbonato 0,5%, suero fetal bovino 10% y antibiótico 1X. (Tabla 2).
-
Las líneas celulares que son incubadas empleando triptosa fosfato como estabilizante de CO2, crecen a mayor velocidad que las células incubadas empleando CO2,se recomienda monitorear su crecimiento cada 24 horas.
-
El crecimiento celular en cajas de 6, 24, 48 y 96 pozos pueden afectarse si no se cuenta con una humedad controlada al 80%, por lo tanto, se recomienda guardar las cajas en bolsas de plástico herméticas, con el fin de evitar evaporación de medios y facilitar un microambiente de CO2
Tabla 2. Tabla 2. Características de los medios y el suplemento a utilizar con cada línea celular evaluada.
| A | B | C |
|---|---|---|
| Linea celular | Medio de cultivo | Suplementos |
| BHK | RPMI 1640 1X con bicarbonato | SFB 10%, AB 1X, TF 10%. |
| HepG2 | MEM 1X con Bicarbonato | SFB 10%, AB 1X, TF 10%. |
| HepG2 | MEM 1X sin bicarbonato | SFB 10%, AB 1X, bicarbonato 0,5%. |
| Vero | DMEM 1X con bicarbonato | SFB 10%, AB 1X, TF 10%. |
| HuH-7 | DMEM 1X con bicarbonato | SFB 10%, AB 1X, TF 10%. |
SFB: Suero fetal bovino.AB: Antibiótico.TF: Triptosa fosfato.
Siembra de células BHK en cajas de cultivo para titulación de Dengue virus por método de plaqueo.
Las células BHK deben ser sembradas 24 horas antes del ensayo de plaqueo viral, para ello es necesario desprender las células y transferirlas a cajas de 6 o 24 pozos. Para lograr desprender las células sin dañar su estructura celular es necesario:- A la caja donde están creciendo las células se les realiza dos lavados con PBS 1X, con el fin de retirar el Suero fetal bovino del suplmento, ya que este contiene inhibidrores de proteasas que inactivan la tripsina. una vez es realizado el lavado a la monocapa celular se debe adicionar tripsina 1X, aproximadamente 400 µL para una caja de 25 cm3es sufuciente u 800 µL para una caja de 75cm3, una vez adicionada la tripsina debe incubarse a 37ºC aproximadamente 3-5 minutos. Revisar constantemente a contra luz o mediante microscopio hasta evidenciar el desprendimiento celular total y evitar tiempos mas prolongados. (evite desprender las células con movimientos bruscos ya que se podrían formar aglomeraciones.)- Cuando se desprendan las células inactive la tripsina empleando 500 uL de Suero fetal bovino, y recolecte las células en tubos de 1,5mL.- Centrifugue a 150 x g durante 5 minutos y descarte sobrenadante, inmediantamente resuspenda las células en 1 mL de medio de cultivo sin suplementos (antibiótico, suero fetal) y realice conteo celular en cámara de Neubauer u otros.- Una vez se conoce el numero de células que se tienen por mL, se deben resuspender el numero adecuado segun la tabla 3 en medio de mantenimiento (RPMI 1X suplementado con suero fetal bovino 2%, Antibiótico 1X y Triptosa fosfato 10% ).Nota: Asegúrese de trabajar con cajas de c| A | B | | --- | --- | | Células / pozo | Caja de cultivo | | 100.000 | 24 pozos | | 300.000 | 6 pozos |
ltivo tratadas/ para células adherente.- Adicionar el numero adecuado de células por pozo de las cajas de cultivo. Tabla 3. Densidad celular en cajas de cultivo para lograr una confluencia del 100% (monocapa celular sin espacios entre las células).
| A | B |
|---|---|
| Células / pozo | Caja de cultivo |
| 100.000 | 24 pozos |
| 300.000 | 6 pozos |
-
Cuando ya estén las células en los pozos de las cajas de cultivo homogeneizar la suspensión de células con movimientos suaves hacia arriba y abajo y hacia los laterales con el fin de evitar que las células formen aglomeraciones y se adhieran solo al centro de los pozos.
-
Guardar las cajas en bolsas herméticas en la incubadora a 37ºC hasta el siguiente da con el fin de permitir que las células se adhieran a la caja y formen la monocapa celular en cada pocillo.
Infección con virus Dengue para la realización de la técnica de plaqueo.
-
Pasadas 24 h después de la siembra de las BHK en las cajas de 6 o 24 pozos, se les realizan dos lavados con PBS 1X para eliminar el antibiótico el cual podría interferir en el proceso de infección viral y se adicionan 180 µL de medio RPMI 1640 1X sin suplementar a cajas de 24 pozos o 900 µL para cajas de 6 pozos.
-
Se descongela una alícuota del virus que se desea titular y se realizan infecciones mediante diluciones seriadas de la siguiente manera: para una caja de 24 pozos con 100.000 células/pozo y 180 µL de medio RPMI 1640 1X se toman 20 µL del virus, se adicionan a los primeros pozos para completar un volumen de 200 µL y se marcan como -1, se realiza una mezcla suave mediante movimientos de la caja, posteriormente se toma de esta dilución 20 µL y se adicionan en los siguientes pozos marcados como -2, se repite el proceso hasta la dilución -7 por triplicado y dejando tres pozos como control de células (CC) ver figura 1.
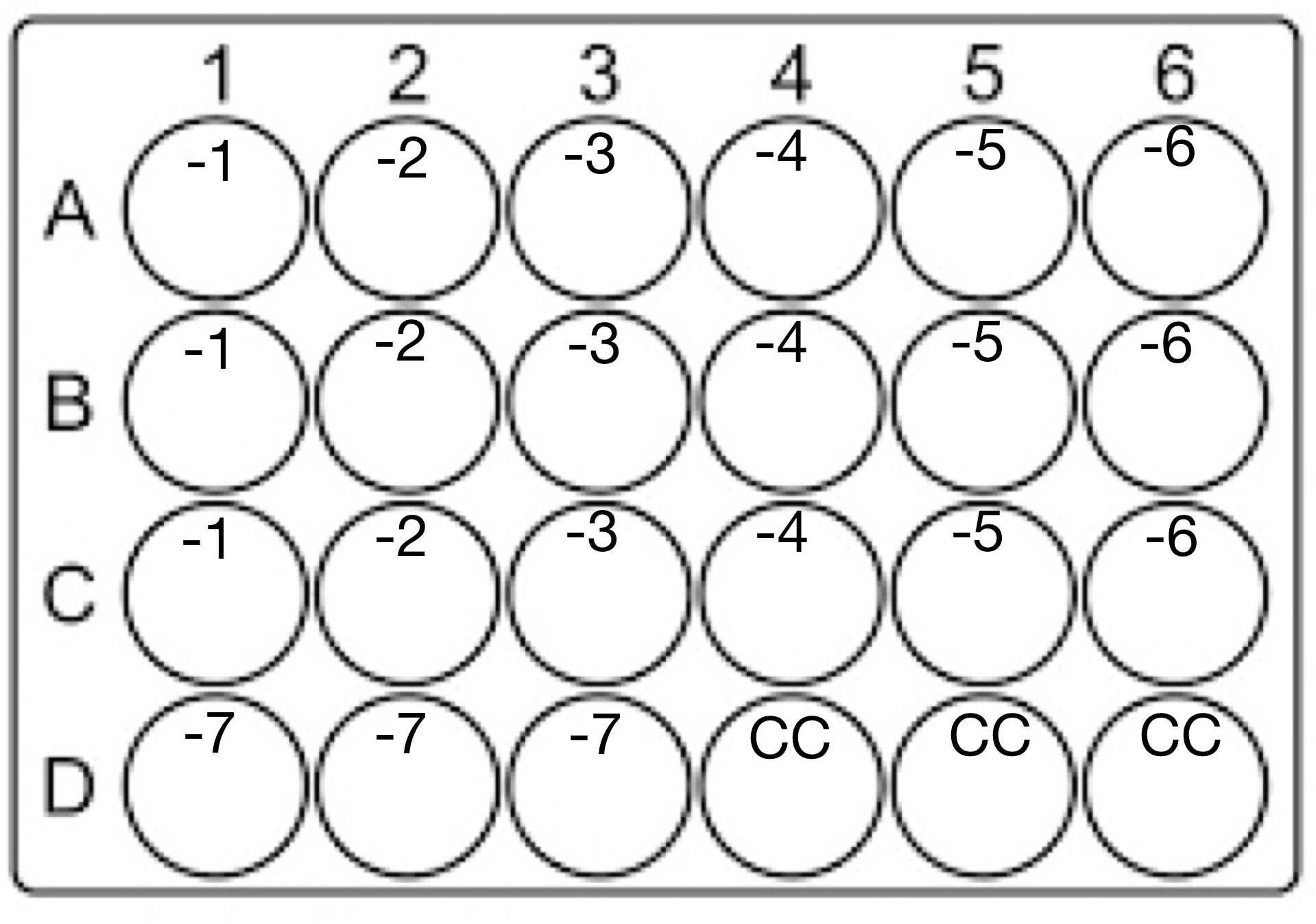
- Una vez realizadas las diluciones se debe Incubar durante 2-3 horas realizando cada 20-30 minutos movimientos suaves a las cajas infectadas. transcurrido este tiempo se descarta el inoculo por inversión y se adiciona 1 mL del medio OVERLAY preparado como se menciono anteriormente y se incuba a 37ºC durante 7 días, las cajas de 6 o 24 pozos deben guardarse en bolsa de plástico con cierre hermético.Nota: durante este proceso de incubación se debe evitar los movimientos bruscos de las cajas o golpes fuertes al cerrar la incubadora para evitar que se generen placas en forma de rayón.

Fijación células y coloración de la titulación
- Terminado el proceso de incubación de 7 dias se deben fijar las células para realizar posteriormente la coloración y evidenciar las placas, para esto se retira el medio OVERLAY mediante inversion de la placa y se adiciona solución al 4% de formaldehído disuelto en PBS 1X. Adicionar 500 µL/pozo a cajas de 24 pozos y 1 mL a cajas de 6 pozos. - Incubar 1-2 horas a temperatura ambiente y lavar con abundante agua (para eliminar restos de overlay y solución de fijación para evitar alteración sobre las placas).Añadir medio de coloración (cristal violeta al 2,5% diluido en etanol al 20% y PBS 1X); incubar 1 hora a temperatura ambiente, lavar exceso de colorante con agua destilada o agua del grifo.- contar el número de virus= (#placas x dilución)/volumen del inóculo en mL
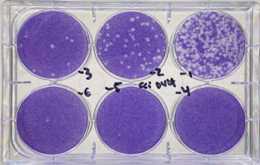
Figura 3. Coloración plaqueo viral.

