Cyanobacteria growth
Ricardo M. Borges, Gabriela de Assis Ferreira, Paulo Iiboshi Hargreaves, Fernanda Chagas, Fernanda FOC Chagas
Abstract
Este documento tem como objetivo apresentar um protocolo abrangente para o cultivo de cianobactérias em meio aquático salino. O protocolo incorpora informações detalhadas sobre a composição das soluções, cálculos fundamentais e volumes requeridos para a execução bem-sucedida de todo o procedimento. É pertinente ressaltar que as taxas de crescimento podem manifestar consideráveis variações interspecíficas entre as diferentes estirpes de cianobactérias.
Steps
Preparo Anterior ao Cultivo
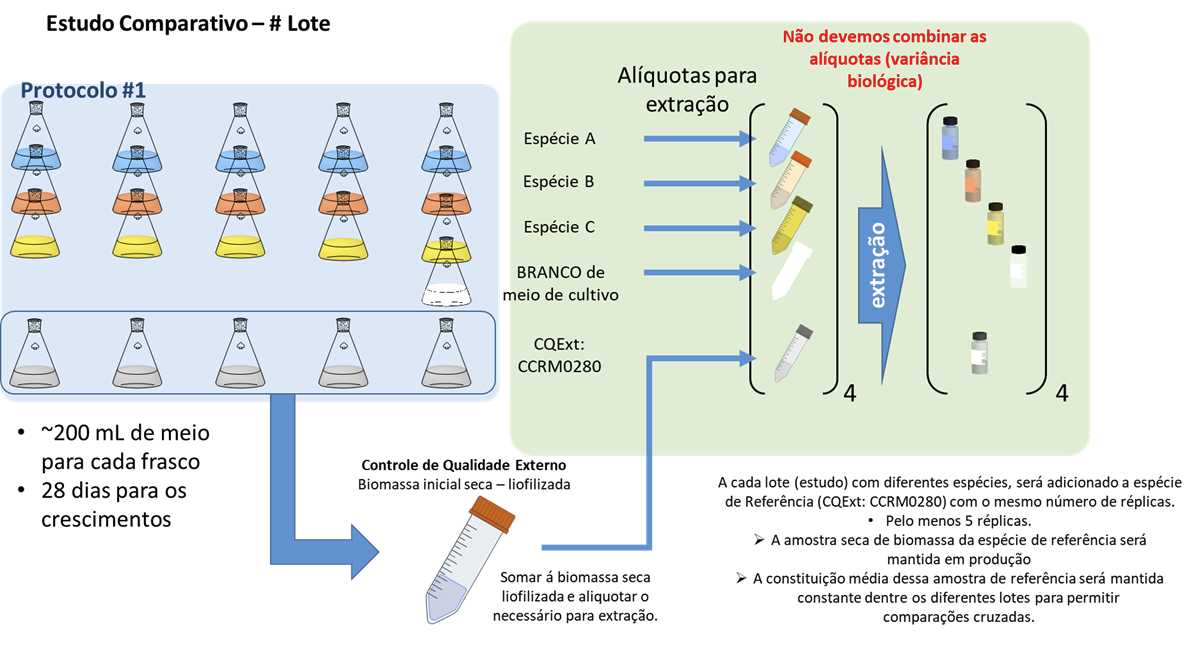
A quantidade de frascos Erlenmeyer de 500 mL necessária variará conforme o número de amostras a serem produzidas. Siga o seguinte esquema:
- X amostras em quintuplicatas (x5)
- Cepa Controle de Qualidade Externo ( CCRM0280 ) em quintuplicatas (x5)
- Amostras Branco de Meio de Cultivo (2 frasco Erlenmeyer tratado da mesma forma com meio e nutrientes, mas sem a etapa de inoculação)
Por exemplo: se estivermos comparando 3 espécies diferentes, serão necessários (3*5) + 5 + 2 (=22) frascos no total.
Preenchimento do Arquivo Metadata:
- Código das amostras
- Código das cepas
- Espécie
- Meios de cultivo
- Data de início
- Datas de adição dos nutrientes
- Data de coleta da biomassa
- Método de extração (média polaridade: Diclorometano-Metanol)
- Método de extração 2 (alta-polaridade: Metanol-Água)
- Comentários
Lembre-se de seguir essas etapas para um registro completo e preciso das informações relacionadas ao experimento.
Material
Frascos Erlenmeyer de 500 mL* Frascos tipo Scotch de 250 mL e de 1 litro
- Tubos de centrifuga de 50 mL do tipo Falcon
- Alças estéreis
- Reagentes para preparo das soluções estoque (ver abaixo)
- Centrífuga de Bancada Refrigerada (Hettich Modelo 320R, Tuttlingen, Alemanha)
- SpeedVac (Christ modelo RVC 2-25, Osterode am Harz, Alemanha) no LabMeta - Instituto de Química - UFRJ
- Liofilizador (modelo L120, Liotop, Brazil)

Preparo das Soluções Estoque:
Solução Estoque de NaNO3 : 3 :
- Utilize um frasco devidamente lavado (lavado previamente com extran 5% e rinsado com água destilada até exaustão)
- Acrescente 7,5 g de NaNO3 (NEON, p# 01813) a 100 mL de água destilada
- Armazene a solução sob resfriamento em geladeira
Uso: 1 mL para cada 1 litro de meio.
Solução Estoque de NaH2PO4•H2O : 2PO4•H2O :
- Utilize um frasco previamente lavado (lavado previamente com extran 5% e rinsado com água destilada até exaustão)
- Adicione 0,5 g de NaH2PO4•H2O (NEON, p# 01415) a 100 mL de água destilada
- Armazene a solução sob resfriamento em geladeira
Uso: 1 mL para cada 1 litro de meio.
Solução Estoque de Metais-Traço:
-
Utilize um frasco lavado (lavado previamente com extran 5% e rinsado com água destilada até exaustão).
-
Adicione os seguintes componentes:
-
23 mg de ZnSO4•7H2O
-
152 mg de MnSO4•H2O
-
7,3 mg de Na2MoO4•2H2O
-
14 mg de CoSO4•7H2O
-
6,8 mg de CuCl2•2H2O
-
4,6 g de Fe(NH4)2(SO4)2•6H2O
-
4,4 g de Na2EDTA•2H2O Complete o volume com água destilada até 1 litro.
-
Armazene a solução sob resfriamento em geladeira
Uso: 1 mL para cada 1 litro de meio.
Solução Estoque de Vitaminas:
-
Utilize um frasco que tenha sido previamente lavado (lavado previamente com extran 5% e rinsado com água destilada até exaustão).
-
Adicione os seguintes componentes:
-
200 mg de Tiamina
-
10 mL (0,1 g) de Biotina
-
1 ml (1 g/l) de Cianocobalamina Complete o volume com água destilada até 1 litro.
-
Armazene a solução sob resfriamento em geladeira
Uso: Após a autoclavagem do meio o, adicione 1 mL para cada 1 litro de meio. .
Preparo de Solução Estoque de Nutrientes:
- Misture:
- 20 ml da Solução Estoque de NaNO3
- 20 ml da Solução Estoque de NaH2PO4.H2O
- 1 ml da Solução Estoque de Vitaminas
- 1 ml da Solução Estoque de Metais-Traço
- Filtração em filtro em 0.22 um
- Armazene a solução sob resfriamento
Preparo dos Tampões de Algodão:
Materiais necessários: algodão hidrofóbico, gaze, tesoura, barbante.
- Corte um pedaço de gaze do tamanho da palma da mão.
- Abra a gaze e insira parte dela dentro do frasco.
- Coloque o algodão hidrofóbico dentro da gaze que está dentro da boca do frasco.
- Continue inserindo algodão até que, ao retirar a gaze com o algodão do frasco, um som semelhante a "puf" seja ouvido (indicando o vácuo causado pelo Tampão ) .
- Corte um pedaço de barbante.
- Amarre a gaze com o barbante, assegurando que fique bem acima do algodão (sem deixar espaço).
- Corte o excesso de barbante e gaze.
- Verifique se o Tampão está um pouco acima da boca do vidro.
- Se necessário, ajuste sua posição.
- Autoclave : 15 minutos a 15 min a 121oC.
- Seque o frasco tampado com os Tampões de algodão na estufa por 8-12 horas a 70°C.
Garanta que cada etapa seja seguida de maneira precisa para assegurar a qualidade do meio de cultivo e dos procedimentos subsequentes.
Os Tampões de algodão são reutilizadas de um cultivo para o próximo. Ao final do cultivo, é suficiente secá-las em uma estufa para evitar a proliferação de fungos.
Preparo do Meio de Cultivo F/2:
-
Para 1 litro de água destilada, adicione:
-
41,5 gramas de sal marinho para aquario (Reef Salt)
-
1 mL de Solução Estoque de NaNO3
-
1 mL de Solução Estoque de NaH2PO4•H2O
-
1 mL de Solução Estoque de Metais-Traço
-
Autoclave: 15 minutos a 15 min a 121oC
-
Aguarde o resfriamento.
-
Adicione 0,5 mL da Solução Estoque de vitaminas antes de usar.
Separe todos os frascos Erlenmeyer de 500 mL
- Lave-os com Extran a 5%.
- Enxágue-os abundantemente com água destilada.
Importante considerar o número de cepas e réplicas a serem cultivadas.
Prepare os Tampões de algodão para vedar os cultivos
Autoclave os frascos previamente lavados com os Tampões de algodão
- Autoclave : 15 minutos a 15 min a 121oC.
- Seque o frasco tampado com os Tampões de algodão na estufa por 8-12 horas a 70°C.
Autoclave os frascos contendo o meio de cultivo F/2
- Para 22 frascos: 22 x 200 ml = 4.4 litros (arredondado para 5 litros).
- Prepare a solução em um frasco de 5 litros e divida em frascos Schott de 1 litro.
- Autoclave : 15 minutos a 15 min a 121oC.
Após o meio de cultivo resfriar, adicione 0,5 mL de solução de vitaminas (previamente filtrada em filtro de seringa: 0.22 um )
- Nota: Não utilize o filtro de seringa de 0.45 um
Identifique cada frasco Erlenmeyer com etiquetas contendo código (rastreável na lista de amostras do projeto) e data de produção* As datas de produção de cada espécime, adição de solução de nutrientes e coletas de biomassa devem ser documentadas na lista de amostras do projeto.
- Garanta que cada etapa seja realizada de forma meticulosa para assegurar um início apropriado para o cultivo e um rastreamento confiável dos processos subsequentes.
Inoculação
Utilizando alças estéreis, proceder à coleta da biomassa de um cultivo previamente preparado
- Quantidade: "tufo" com dimensões semelhantes a uma moeda de 50 centavos.
- É imperativo realizar todas as operações utilizando luvas descartáveis e minimizar a exposição ao fluxo de ar.
- Vede adequadamente os frascos Erlenmeyer com os Tampões de algodão preparados anteriormente.
Manutenção do Cultivo
Para manter as cianobactérias em fase logarítmica, é essencial fornecer alimentação frequente por meio da adição da Solução Estoque de Nutrientes , preparada previamente
- Em cada cultivo, é recomendado adicionar 200 μL da Solução Estoque de Nutrientes .
A necessidade de nutrientes nas cianobactérias pode ser visualizada pela sua coloração verde característica.
Coleta da biomassa e tratamento
O período de cultivo está estipulado em:
- 28 dias.
- Com a adição da Solução Estoque de Nutrientes a cada intervalo de 7 dias.
Ao término dos 28 dias, de cada frasco Erlenmeyer, será coletada uma quantidade que corresponda visualmente a 80-90% da biomassa
- Permitiremos que cada espécime continue seu crescimento até que seja necessário interrompê-lo.
- Inicialmente, podemos fixar um limite de 4 meses para cada espécime.
Transfira o meio de cultivo de cada frasco Erlenmeyer com a biomassa para um tubo cônico de centrífuga de 50 mL (tipo Falcon), devidamente identificado com etiqueta (correspondente ao código de referência na lista de amostras)
- Centrifugue : 3011 xg (4500 rpm) por 15 minutos a 4°C
- Descarte o sobrenadante
- Continue transferindo o conteúdo de cada frasco Erlenmeyer, centrifugando e descartando o sobrenadante até completa eliminação de todo o conteúdo aquoso
- Registre o volume de biomassa obtido (foto para arquivo)
Submeta cada amostra devidamente identificada a processo de liofilização à secura
- Cada amostra deve ser identificada separadamente em tubos Falcon limpos e semi-rosqueados (para nao haver contaminação cruzada das amostras)
- Inserir detalhes e observações pertinentes no Metadata.
- Sempre armazene em freezer a -20 oC

