Collect and Extract Biomass Cyanobacteria
Ricardo M. Borges, Fernanda Chagas, Fernanda FOC Chagas
Abstract
Protocolo Abrangente para a Extração de Biomassa de Cianobactérias Cultivadas em Laboratório.
É crucial prestar uma atenção meticulosa a materiais de qualidade, envolvendo solventes de grau HPLC, microtubos imaculados e ponteiras Eppendorf Quality nunca antes utilizados. Controles rigorosos de qualidade abrangem "Branco de Cultivo" (meio de cultivo sem adição de cianobactéria), "Branco de Extração" (recipiente de extração sem biomassa), "Controle de Qualidade Combinadas (QC-pool)" (contendo alíquotas dos diferentes cultivos) e "Controle de Qualidade Externo" (cepa CCRM0280 cultivada simultaneamente).
Entende-se por:
-
Branco de Cultivo : meio de cultivo desprovido de inoculação cianobacteriana, submetido aos mesmos procedimentos das amostras com cianobactérias cultivadas.
-
Branco de Extração : frasco de amostra para extração (microtubo de 2 mL com tampa de rosca) desprovido de biomassa seca, submetido aos mesmos procedimentos de extração.
-
Controle de Qualidade Combinadas (QC-pool) : amostra representativa do estudo que representará uma média fiel a todos os metabólitos extraídos. Pode ser usado, inclusive para otimização dos parâmetros técninco de análise.
-
Controle de Qualidade Externo (QCExt) : A amostra contendo a cepa CCRM0280 cultivada em paralelo servirá como referência para estudos comparativos. Após a secagem, a nova amostra de CCRM0280 obtida no atual cultivo será combinada com o estoque de CCRM0280-CQExt para distribuição equitativa de Controle de Qualidade interlote. Este protocolo está descrito em documento próprio.
Before start
Importante:
- Antes de iniciar o procedimento, é imperativo que todo o protocolo seja minuciosamente lido e compreendido . Além disso, uma conversa com o responsável é essencial para esclarecer quaisquer dúvidas antes da execução das etapas. Isso garantirá que o procedimento seja conduzido de maneira precisa e confiável.
Steps
Material e Equipamentos
Microtubos com tampa de rosca de 2 mL (e.g. SSIbio) para FastPrep novos (nunca usados)* Microtubos do tipo Eppendorf (Eppendorf Quality, Eppendorf, Hamburg, Germany) de 2 mL novos (nunca usados)
- Ponteiras P1000 (Eppendorf Quality, Eppendorf, Hamburg, Germany) novas (nunca usadas)
- Esferas de Zirconia de 1 mm (e.g. BioSpec) novas (nunca usadas)
Dica: usar um "gabarito" para medir uma quantidade única, em volume, de esferas para cada amostra

-
Metanol grau HPLC (Tedia, Fairfield, OH, USA | Honeywell, Charlotte, NC, USA)*
-
Diclorometano grau HPLC (Tedia, Fairfield, OH, USA | Honeywell, Charlotte, NC, USA)*
-
Água ultrapura (e.g. Milli-Q) *ou outro de qualidade comparável.
-
FastPrep (FastPrep-24, MP Biomedicals LLC ., Santa Ana, CA, USA) no Plataforma de Expressão, Purificação e Análise de Biomoléculas (PEPAB) - Biofícia - UFRJ
-
Cuba de Ultrassom (Cristofoli, Brasil)
-
Vortex (mod. 772, Fisatom)
-
Centrífuga de Bancada Refrigerada (Hettich Modelo 320R, Tuttlingen, Alemanha)
-
Pipeta automática P1000 (Eppendorf, Hamburg, Germany)
-
SpeedVac (Christ modelo RVC 2-25, Osterode am Harz, Alemanha) no LabMeta - Instituto de Química - UFRJ

Coleta da Biomassa
Após 28 dias, extraia ~80-90% de biomassa de cada frasco Erlenmeyer (quantidade determinada apenas visualmente)
- Permita que os espécimes cresçam até formar uma boa quantidade de biomassa, com um limite tentativo empírico de quatro meses por espécime.
Será permitido que cada espécime se mantenha crescendo até que seja necessário interromper o cultivo por algum motivo (excesso de biomassa, morte celular etc).
A princípio, será estabelecer um limite de quatro meses para cada espécime.
-
Transfira o meio de cultivo de cada frasco Erlenmeyer com a biomassa para um tubo cônico de centrífuga de 50 mL do tipo Falcon, devidamente identificado com etiqueta (correspondente ao código de referência na lista de amostras)
-
Centrifugue : 3011 xg (4500 rpm) a 4°C por 15 minutos
-
Descarte o sobrenadante
-
Continue transferindo o conteúdo de cada frasco Erlenmeyer, centrifugando e descartando o
sobrenadante até completa eliminação de todo o conteúdo aquoso
- Registre o volume de biomassa obtido (foto para arquivo)
- Se possível, filtre e seque a biomassa obtida anteriormente.
- Isso pode não ser viável em alguns casos.
- Submeta cada amostra devidamente identificada a processo de liofilização à secura
- Cada amostra deve ser identificada separadamente em tubos Falcon limpos e semi-rosqueados (para nao haver contaminação cruzada das amostras)
- Inserir detalhes e observações pertinentes no Metadata.
- Sempre armazene em freezer a -20 oC
Prepare o material para a etapa de extração
Verifique os códigos nas etiquetas e na lista de amostras de biomassa seca.
-
Organize os microtubos para adição de biomassa seca (microtubos com tampa de rosca de 2 mL) e para estoque de extratos (microtubos do tipo Eppendorf de 2 mL - Eppendorf Quality).
-
Identifique todos com etiquetas apropriadas, de acordo com a tabela de amostras. Todos os materiais (microtubos Eppendorf, ponteiras Eppendorf, vials etc) devem ser novos. Nunca reutilize esses materiais para essa finalidade.
Extração da Biomassa - para obtenção de metabólitos de baixa a média-polaridade
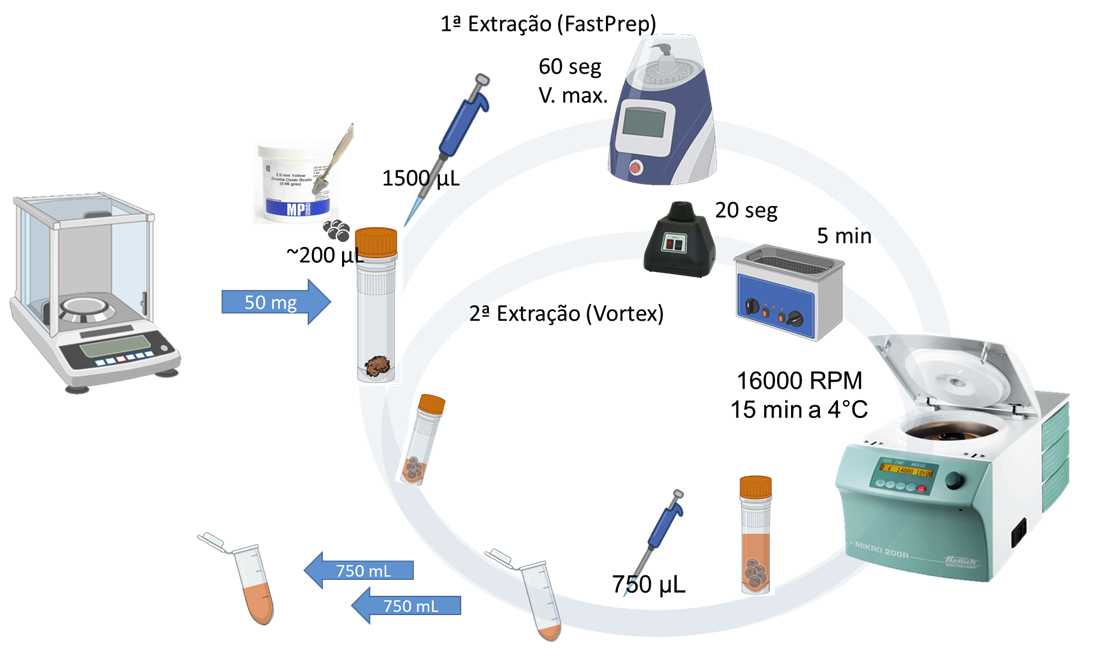
- Pese 50 mg da biomassa seca e transfira para um microtubo de 2 mL com tampa de rosca.
- Incluir as amostras Branco de Extração : frascos vazios adicionados a partir desta etapa, no início e final da sequência de amostras, e em intervalos de 10 amostras.
- Adicione cerca de 200 µL de Esferas de Zircônia a cada amostra de biomassa contida nos microtubos de 2 mL com tampa de rosca (use o gabarito para transferencia de esperas mencionado acima)
- Trate sempre as amostras de Branco analítico como se fossem amostras reais.
- Adicione 1,5 mL do solvente de extração escolhido (neste caso: diclorometano-metanol, na proporção 2:1, v/v ) a todos os microtubos de tampa de rosca
- Homogeneize todas as amostras por 60 segundos na velocidade mais alta (6 m/s) do homogeneizador FastPrep
- Centrifugue todas as amostras a 24900 xg (16000 rpm) por 15 minutos a 4°C
- Colete 750 µL (0,750 mL) do sobrenadante de todas as amostras em novos microtubos do tipo Eppendrof de 2 mL (Eppendorf Quality), devidamente identificados com etiquetas
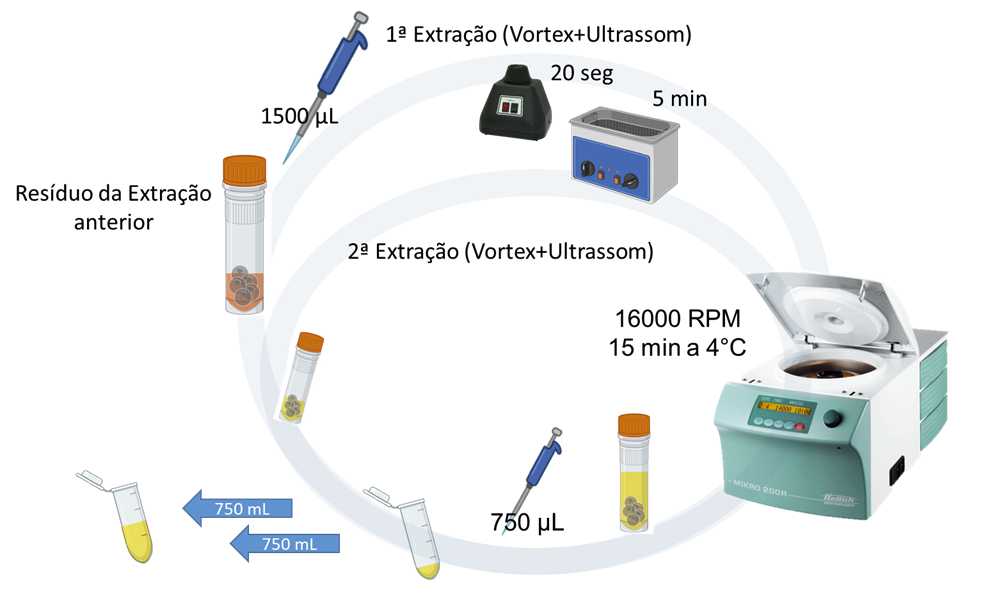
REPETIR A EXTRAÇÃO:
- Adicione mais 750 µL (0,750 mL) do mesmo solvente de extração escolhido (neste caso: diclorometano-metanol, 2:1, v/v) a todos os frascos
- Homogeneize as amostras por 20 segundos em agitador do tipo Vortex, seguido por banho de ultrassom por 5 minutos
- Centrifugue todas as amostras a 24900 xg (16000 rpm) por 15 minutos a 4°C
- Evapore completamente todas as amostras utilizando o SpeedVac até a secura
- Armazene todas as amostras em freezer (-80o)até o momento da preparação para análise.
Extração da Biomassa - para obtenção de metabólitos de alta polaridade
- Adicione 1,5 mL do solvente de extração mais polar escolhido (neste caso: metanol-água, na proporção 1:1, v/v ) a todos os microtubos de tampa de rosca contendo o resíduo de biomassa extraído previamente
- Homogeneize as amostras por 20 segundos em agitador do tipo Vortex, seguido por banho de ultrassom por 5 minutos
- Centrifugue todas as amostras a 24900 xg (16000 rpm) por 15 minutos a 4°C
- Colete 750 µL (0,750 mL) do sobrenadante de todas as amostras em novos microtubos do tipo Eppendorf de 2 mL (Eppendorf), devidamente identificados com etiquetas
REPETIR A EXTRAÇÂO:
- Adicione mais 750 µL (0,750 mL) do mesmo solvente de extração mais polar scolhido (neste caso: metanol-água, 1:1, v/v) a todos os frascos
- Homogeneize as amostras por 20 segundos em agitador do tipo Vortex, seguido por banho de ultrassom por 5 minutos
- Centrifugue todas as amostras a 24900 xg (16000 rpm) por 15 minutos a 4°C
- Evapore completamente todas as amostras utilizando o SpeedVac até a secura
- Armazene todas as amostras em freezer (-80o)até o momento da preparação para análise.
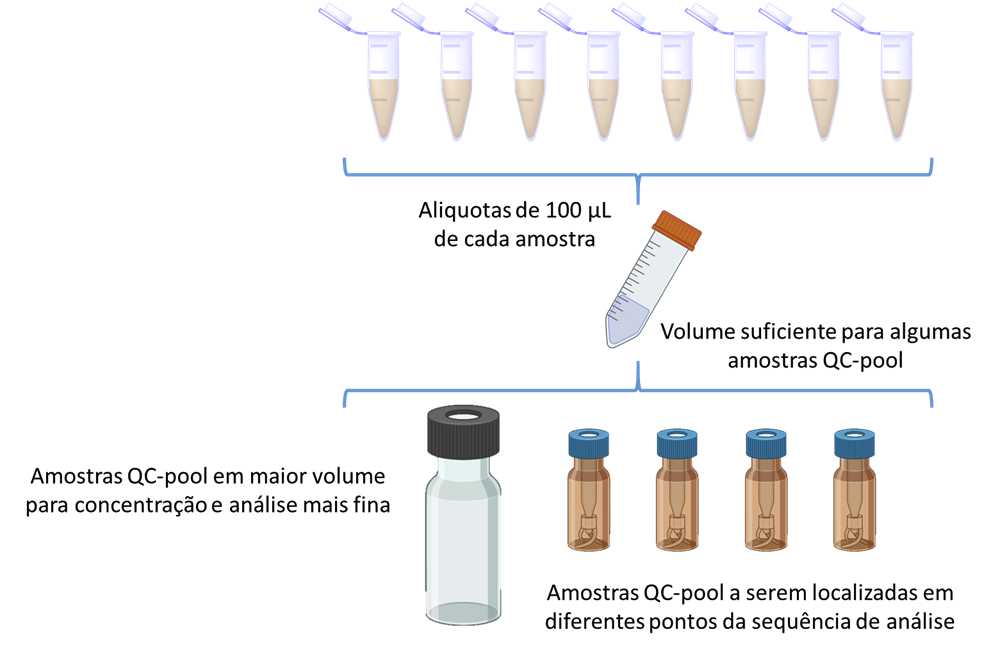
Amostras de Controle de Qualidade POOL (combinadas)
- Após o preparo das amostras para análise (ressuspensão em solvente para injeção), prepare as amostras de Controle de Qualidade Combinadas (QC-pool) a partir da combinação de aproximadamente 10% do volume (50 µL) de cada amostra produzida em um frasco de 20 mL
- As aliquotas de 100 µL devem ser transferidas para 4 novos vials analíticos previamente identificados, formando um conjunto de amostras QC-pool.
- A quantidade sobressalente será armazenada para avaliação futura (p.ex.: análise de RMN 2D).
Resultados Esperados
Ao término do protocolo, é esperado obter extratos de baixa a média polaridade e alta polaridade para cada amostra produzida , além das amostras de Controle de Qualidade (Branco de Extração e QC-pool), permitindo uma análise abrangente e comparativa dos metabólitos sendo produzidos pelas diferentes cianobactérias, e com controle de qualidade inter-lotes.