构建重组质粒是将一个外源目的DNA片段插入特定载体,以用于基因表达、功能研究或基因治疗的核心技术。整个过程如同一次精确的“分子手术”,遵循一套标准化流程。本文将这一过程拆解为五个逻辑严密的步骤,并提供关键操作要点。
一、 整体流程导图:从蓝图到成品
一次成功的质粒构建,本质是完成一次 “设计-制备-组装-导入-验证” 的完整循环:精准设计引物 → 扩增获取目的片段 → 酶切并连接 → 转化至细菌 → 筛选与最终鉴定
二、 分步详解与实操要点
步:引物设计——奠定成功的基石
此步骤的目标是设计出能特异性扩增目标基因、并为其装上与载体匹配的“通用接口”的引物。
-
获取序列:在NCBI数据库中准确找到目标基因的CDS(编码序列)。
-
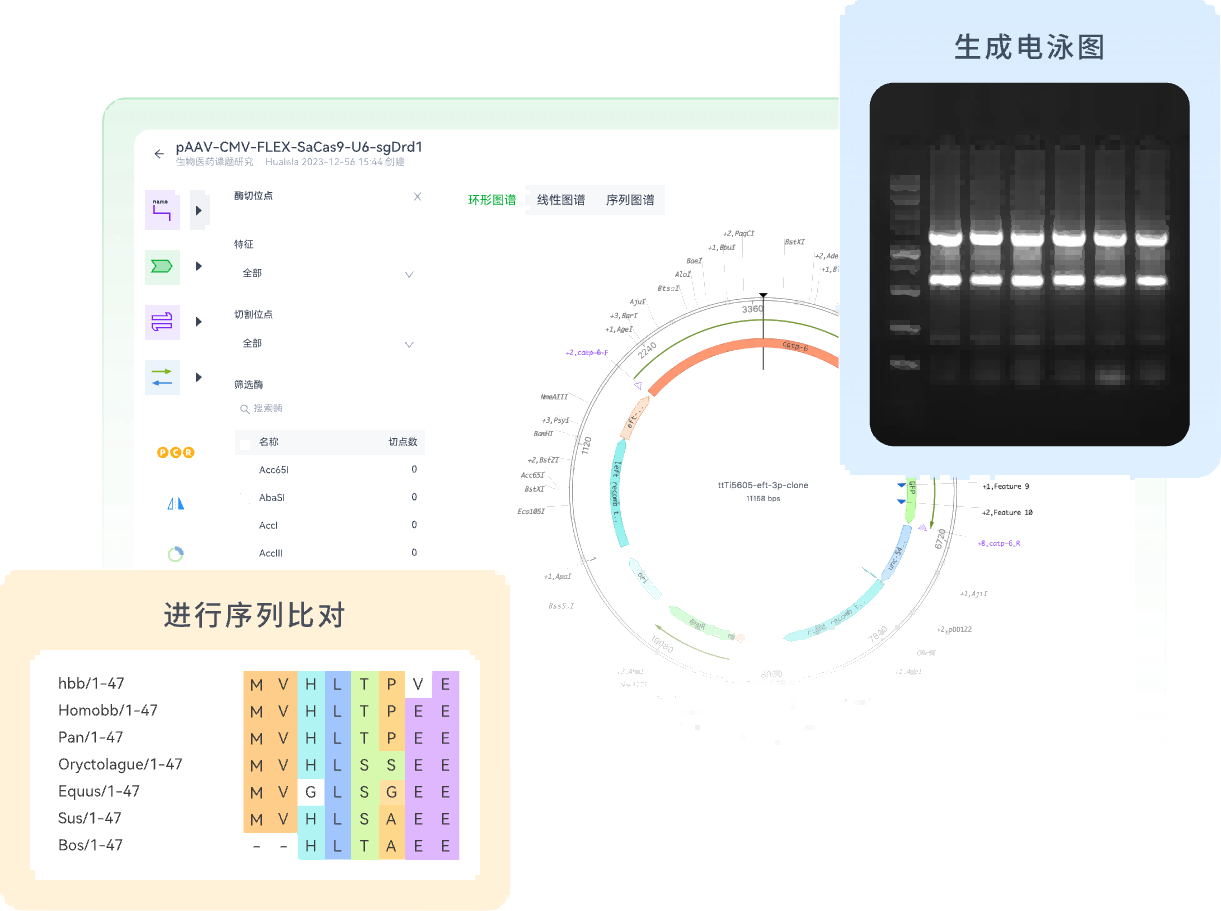
选择“接口”(酶切位点):使用SnapGene等软件分析,在载体多克隆位点区域选择 两个不同的 限制性内切酶位点。核心原则:这两个位点在目的基因内部绝对不能出现。
-
设计合成引物:在引物5‘端添加选定的酶切位点序列及保护碱基。引物长度通常为18-25 bp,TM值宜在55-65℃之间。
-
关键要点:双酶切设计可有效防止载体自连,是提高连接效率的最佳策略。
第二步:PCR扩增——制备“基因零件”
通过聚合酶链式反应,大量、特异地制备带有酶切位点的目的DNA片段。
-
建立反应体系:以高质量cDNA或质粒为模板,加入设计好的引物、高保真DNA聚合酶、dNTPs等。
-
优化反应程序:退火温度需根据引物TM值进行梯度优化;延伸时间按聚合酶速度及产物长度设定。
-
验证与纯化:PCR产物必须经琼脂糖凝胶电泳验证大小正确,并通过胶回收试剂盒纯化,去除引物、酶等杂质,为后续酶切做准备。
第三步:酶切与连接——完成“分子拼接”
用相同的“分子剪刀”处理目的片段和载体,再用“分子胶水”将其连接成环状重组质粒。
-
双酶切消化:使用选定的两种限制性内切酶,同时对纯化的PCR产物和空载体质粒进行切割。建议使用可兼容的缓冲液进行单管双酶切以节省时间。
-
纯化线性化载体:载体酶切后必须进行凝胶电泳,回收线性化条带,以彻底去除未切割的环状质粒背景,这是降低假阳性克隆的关键。
-
连接反应:将酶切纯化后的目的片段和载体按摩尔比(通常3:1至10:1)混合,加入T4 DNA连接酶,于16℃连接2小时或过夜。
第四步:转化与涂板——将重组体送入细菌“工厂”
将连接产物导入感受态细胞,并通过抗生素筛选获得含有重组质粒的细菌克隆。
-
热激转化:将连接产物与感受态细胞在冰上混合,经42℃精准热激45-60秒,使DNA进入细胞。
-
复苏培养:加入无抗性LB培养基,37℃温和振荡培养45-60分钟,使细菌恢复并表达质粒编码的抗性基因。
-
抗性筛选:将菌液涂布于含有相应抗生素的LB平板上,37℃倒置培养12-16小时。只有成功转入重组质粒的细菌才能生长形成单菌落。
第五步:菌落鉴定与验证——确认“最终产品”
从平板上筛选阳性克隆,并进行多层次验证以确保构建完全正确。
-
初筛(菌落PCR或酶切鉴定):
-
终审(DNA测序):将酶切鉴定正确的菌液或质粒送至测序。将测序结果与目标基因序列进行比对,这是确认序列无误、无移码或突变的金标准,必不可少。
三、 成功构建的核心要诀
-
设计决定成败:精心的双酶切位点选择和引物设计是成功的根本。
-
纯度至关重要:每一步的凝胶验证与产物纯化,是保证下一步反应效率的基础。
-
设立对照:在PCR、酶切、转化等关键步骤设置阳性与阴性对照,能迅速排除实验故障。
-
双重验证原则:必须结合 酶切鉴定(快速、经济)和 测序验证(准确、终极),方可确认重组质粒构建成功。
通过遵循以上五步流程并关注核心要点,即可系统、高效地完成重组质粒的构建,为下游的细胞转染、蛋白表达或基因功能研究提供可靠的材料基础。
