m6A(N6-Methyladenosine)甲基化修饰已成为近年来科研圈的“明星”(通过Pubmed检索"m6A"关键词,可以看出近10年内m6A的文章逐年增长,作为表观转录组中最丰富的化学修饰之一,m6A在多种生理过程中发挥着调控基因表达的关键作用。在了解m6A甲基化修饰之前,我们先了解一下什么是表观转录组。
表观转录组表观转录组(Epitranscriptome)指
RNA分子上所有可逆化学修饰的集合,这些修饰不改变RNA序列,但可以通过调控基因表达(如翻译、降解、剪接等)发挥作用。RNA修饰广泛存在于各种RNA类型中,包括mRNA、tRNA、rRNA、snRNA、snoRNA、miRNA、siRNA、piRNA和lncRNA等。目前已知的 RNA修饰超过150种,常见类型包括甲基化(如m6A、m5C)、羟基化、假尿苷化(Ψ)等。其中RNA甲基化是最常见的修饰类型之一,在mRNA、tRNA等分子中占比较高(如哺乳动物 mRNA 中 m6A 修饰可占甲基化修饰的 80% 以上)。RNA甲基化,是指在甲基转移酶(如 METTL 家族、CMTR 家族等)的催化下,将甲基基团(-CH3)通过共价键连接到RNA分子中核苷酸的特定原子上的修饰过程。RNA 甲基化修饰存在多种类型,包括 m6A、m5C、m1A、m7G 等。
m6A甲基化修饰m6A甲基化修饰即RNA分子腺嘌呤第6位氮原子(N6位)上的甲基化修饰。m6A甲基化修饰是真核生物mRNA最普遍的内部修饰之一,约占到mRNA甲基化修饰的80%。m6A在调控基因表达(如调节mRNA可变剪切、稳定性、降解速率及翻译效率等)中起着重要作用。
m6A修饰主要发生在RRACH(R = G或A,H = A、C或U )这类motif上,这类motif主要在mRNA的终止密码子和3’UTR处富集,即m6A主要发生在终止密码子和3’UTR附近。研究表明,m6A最主要的功能是调控mRNA稳定性:在胞质中,m6A修饰可被阅读器
蛋白YTHDF2识别,通过招募相关因子将mRNA富集至Processing body(P-body),从而加速其降解。此外,m6A修饰可通过改变RNA局部二级结构(如茎环结构),暴露或遮蔽microRNA的结合位点,进而调控microRNA介导的mRNA降解效率。在核内,m6A修饰被核内阅读器YTHDC1识别后,可通过招募剪接因子(如SRSF家族
蛋白)调控RNA可变剪接,并与核输出受体NXF1互作促进mRNA出核,最终实现基因表达调控。值得注意的是,m6A与DNA甲基化之间存在双向互作
网络,例如m6A甲基转移酶METTL3可通过稳定DNA甲基转移酶DNMT3A的mRNA,间接增强基因组DNA甲基化水平,而DNA甲基化状态也可通过表观遗传调控影响m6A相关酶的转录。☟ 下图展示了目前已知的部分m6A的生物功能。
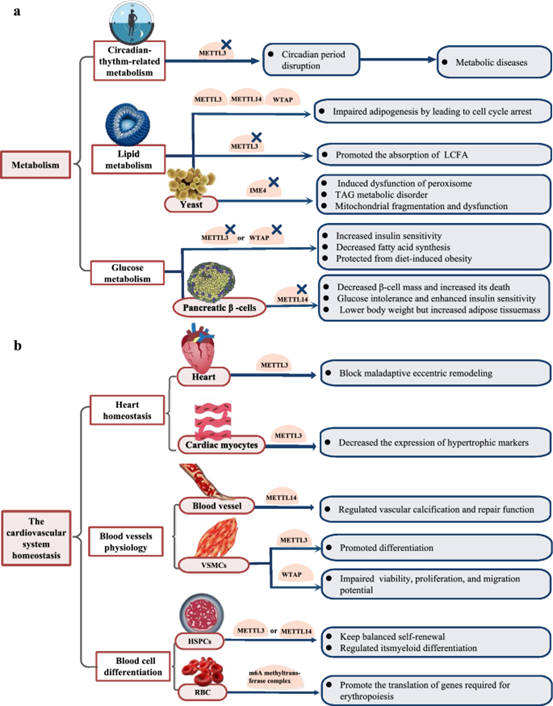
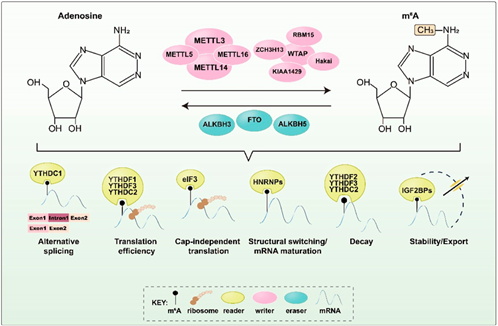
m6A的调控机制:m6A甲基化修饰是动态可逆的生物过程,这种动态变化依赖于多种功能的酶进行调节,主要包括三种类型:甲基转移酶(Methyltransferases)、去甲基化酶(Demethylases)以及甲基化识别
蛋白(Binding proteins)。甲基转移酶(Writers)也称为 “写入器”,负责催化 mRNA 等 RNA 分子的碱基发生 m6A 甲基化修饰。核心成员包括METTL3/METTL14 复合物(催化 m6A 的直接添加),以及辅助因子WTAP、VIRMA、KIAA1429等(参与酶复合物定位或底物识别),此外还包括METTL16、RBM15/15B、ZC3H3、CBLL1等具有特定生物学功能的甲基转移酶。去甲基化酶(Erasers)也称为 “擦除器”,负责催化 m6A 修饰的去除。目前已知的 m6A 去甲基化酶包括FTO和ALKBH5,可特异性移除 mRNA 中的甲基基团,实现修饰的动态调控。m6A 识别
蛋白(Readers)也称为 “阅读器”,通过特异性结构域识别m6A修饰的RNA,招募下游效应因子或改变RNA构象,从而调控mRNA的稳定性、剪接、翻译等过程。主要分为两类:1、含YTH结构域的
蛋白:• 胞质型:YTHDF1(促进翻译)、YTHDF2(介导mRNA降解)、YTHDF3(协同前两者功能);• 核内型:YTHDC1(调控剪接和出核)、YTHDC2(参与翻译起始)。2、非YTH结构域的蛋白:• IGF2BP1/2/3(通过m6A修饰增强mRNA稳定性);• HNRNPA2B1(识别m6A并调控靶基因的选择性剪接)。不同物种中,m6A 阅读器的功能存在特异性:例如,高海拔哺乳动物通过YTHDF1 识别缺氧相关基因(如 HIF-1α)mRNA 的 m6A 修饰,增强其翻译效率,从而抵抗缺氧诱导的细胞凋亡,体现了表观调控对环境适应的重要性。
M6A甲基化测序(MeRIP-seq)技术m6A修饰早在1970年代通过放射性标记技术被发现,而其在转录组中的全基因组分布特征最早通过二代测序(NGS)技术揭示。研究表明,在哺乳动物中,约25%的mRNA分子含有m6A修饰,平均每个转录本携带1-3个修饰位点,主要分布于终止密码子附近及3'UTR区域。甲基化RNA免疫沉淀测序(MeRIP-seq/m6A-seq)通过特异性抗体富集含m6A的RNA片段,结合高通量测序可定位到约100 nt分辨率的修饰区域,已广泛用于m6A修饰的检测。MeRIP-seq/m6A-seq技术原理为通过特异识别m6A修饰的抗体,对细胞内具有m6A修饰的RNA片段进行免疫共沉淀。对沉淀下来的RNA片段进行高通量测序,结合生物信息学分析,即可在全基因组范围内系统解析m6A修饰的分布特征、富集序列模式及潜在调控功能。该技术是目前研究 m6A 修饰最广泛使用的方法之一,已被应用于揭示m6A在发育、疾病等过程中的动态调控机制。
MeRIP-seq是基于免疫沉淀富集技术,该技术包括IP和input两个文库:IP文库是通过m6A特异性抗体富集含甲基化修饰的RNA片段,用于检测m6A修饰的分布;Input文库为未进行免疫沉淀的RNA样本(处理流程与IP一致),作为对照用于排除非特异性结合。 通过比较IP与Input文库的测序信号,可绘制全基因组范围内的m6A修饰图谱,单独的input文库可视为RNA-seq文库,可用于进行表达图谱的分析。文库构建原理图如下:
生信分析流程示意图如下:
今天为大家介绍的内容以基础知识为主,旨在为大家筑牢理论根基,希望能对大家有所助益。后续我们将为大家分享m6A的应用实例,敬请期待!